النشاط الإشعاعي الصناعي وعمر النصف
قبل أن نبدأ موضوعنا عن النشاط الإشعاعي الصناعي نريد أن نعرف مايلي :
التحلل الإشعاعي وعمر النصف :
عرفنا بأن النشاط الإشعاعي للمواد المشعة هو نتيجة لتحول بعض الذرات إلى ذرات مادة أخرى أقل منها أو أكثر منها عدداً ذرياً وعدداً كتلياً بعد أن تقذف بعدد من الجسيمات أو الأشعة , أي إن عدداً من أنوية هذه المواد المشعة ستتحلل وتقل عدد النيوكلونات فيها .وتختلف سرعة انحلال العناصر بواسطة النشاط الإشعاعي من مادة إلى أخرى ويعبر عن ذلك التغير باستخدام تعبير عمر النصف .
وهناك ثلاث سلاسل للتحلل الإشعاعي الطبيعي وهي :
- سلسلة اليورانيوم
- سلسلة الثوريوم
- سلسلة الأكتينيوم
ويمكن أن نعرف عمر النصف للعنصر المشع بأنة عبارة عن الزمن اللازم لانحلال نصف كمية المادة المشعة بواسطة النشاط الإشعاعي .
ويتوقف عمر النصف لأي عنصر على عدده الذري ونشاطه الإشعاعي .
قياس وحساب شدة النشاط الإشعاعي
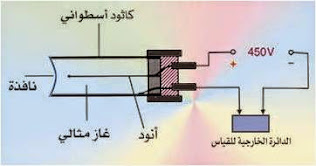
يمكن قياس شدة النشاط الإشعاعي باستخدام جهاز يسمى عداد جيجر
ويتركب هذا الجهاز من :
- أسطوانة معدنية مقفلة من الجانبين , بأحد وجهيها فتحة على شكل نافذة من الميكا , تسمح بدخول الأشعة المنبعثة من المادة المشعة , وتملأ الإسطوانة بواسطة غاز خامل , ويوجد في محور الإسطوانة سلك معدني يتصل بقطب موجب لبطارية يعمل كأنود بينما يتصل جدار الأنبوبة بالقطب السالب للبطارية ويعمل ككاثود , ويوجد في الدائرة الخارجية مقاومة وعداد للنبضات الكهربائية .
فكرة العمل :
عند دخول الأشعة المنبعثة من العينة فإنها تعمل على تأين ذرا ت الغاز الخامل داخل الإسطوانة بدرجة تعتمد على شدة النشاط الإشعاعي للعينة ويتولد عن ذلك عدد من الأيونات الموجبة والإلكترونات السالبة يتوقف على درجة تأين ذرات الغاز الخامل التي تعتمد على شدة النشاط الإشعاعي .
ويعمل الجهد الموجب للأنود على جذب الإلكترونات السالبة إلية بينما تنجذب الأيونات الموجبة إلى الجهد السالب للكاثود , فتتكون نبضات كهربية في الدائرة الخارجية يعمل العداد على حساب عددها وبالتالي قياس شدة النشاط الإشعاعي .
النشاط الإشعاعي الصناعي :
تعتمد الخصائص الكيميائية للعناصر على الأعداد الذرية للعناصر وخاصة عدد الالكترونات الموجودة في مستوى الطاقة الخارجي , لكن تختلف في الخصائص النووية فهي تعتمد على عدد البروتونات والنيوترونات فيها .
فلو إخذنا على سبيل المثال نظائر الكربون تتمتع بخصائص نووية مختلفة , وخصائص كيميائية واحدة يعني غير مختلفة .
فلدينا نظائر الكربون 106c , 116c , 146c نظائر مشعة , بينما 126c , 136c تعد نظائر مستقرة .
ولو نظرنا الى مكونات النوى , لوجدنا أن هناك علاقة بين نسبة عدد البروتونات إلى عدد النيوترونات داخل النواة وبين استقرار النواة أو عدمة .
أي أن استقرار النواة , وعدم استقرارها يعتمدان على النسبة بين عدد النيوترونات وعدد البروتونات فيها .
فعند إحداث التغيير في مكونات أي نواة يسمى ذلك بالتفاعل النووي , ولإحداث تفاعل نووي بين أي نواتين نقربهما من بعضهما إلى مسافة يبدأ عندها تأثير القوى النووية , ولاحداث ذلك يتم تسريع إحدى النواتين لإكسابها طاقه حركية كافية بحيث تمكنها الأقتراب من النواة الأخرى ثم التغلب على قوى التنافر الكهروسكونيه وتسمى هذه بالنواة القاذفة أو الجسيم القاذف ويستخدم لتسريعها أجهزه خاصة تعرف باسم المسارعات النووية .
وعندما تتغير عدد النيوكليونات في نواة عنصر مستقرة نتيجة قذفها بجسيم ( بروتون , نيوترون , جسيم ألفا) فتتحول إلى نواة عنصر آخر , فإذا كانت النواة الجديدة غير مستقرة , فإنها ستشع ويسمى النشاط الإشعاعي في هذة الحالة النشاط الإشعاعي الصناعي .
ففي عام 1919 م استطاع العالم رذرفورد تحويل نواة عنصر إلى آخر عندما أجرى أول تفاعل نووي صناعي حيث قذف نوى النتروجين 147N بجسيمات ألفا , لينتج من هذا التفاعل النووي نوى أكسجين 178O وبروتونات وتوضح المعادلة الآتية هذا التفاعل النووي :
11H + 178O → 147N + 4 2He
و جسيمات ألفا التي تنبعث من المصدر المشع بدورها تصطدم بنوة النتروجين , مستقرةً بداخلها مكونة نواة جديدة هي نواة عنصر الفلور 189Fغير المستقرة والتي تمتلك طاقة عالية جداُ , ولكي تعود إلى حالة الأستقرار فإنها تشع بسرعة بروتوناً فتتحول النواة إلى حالة عنصر آخر هو الأوكسجين .
ويمكن الملاحظة بأن هذه العملية تتم في فترة زمنية قصيرة تقريباً 10 9 ثا , وتتم هذه التفاعلات حسب المعادلتين التالية :
1) * [ 189F ] → 147N + 4 2He
2) 11H + 178O → * [ 189F ]
وهناك الكثير من الأمثلة على التفاعلات النووية ومنها :-
1) 4 2He+ 2412Mg → * [ 2814Si ] → 2713Al + 1 1H
2) 4 2He+ 2411Na → * 28 13Al]] → 2412Al + 2 1H
تعليقات
إرسال تعليق